坂本順司教授らの論文がScience誌に掲載されました。
掲載日:2019年10月07日
坂本順司教授は、ドイツ マックス-プランク生物物理学研究所の研究グループらとの共同研究で、大腸菌で働くシトクロムbd型呼吸酵素の、原子レベルの精密立体構造を解明しました。
この研究成果は世界的に権威ある科学雑誌であるScience誌に掲載されました(大学のプレスリリース)。
本研究成果のより詳しい解説について以下をご覧ください。
【研究概要】
「呼吸酵素」とは、動物や微生物の細胞にあって、生命活動に必要なエネルギーを食物の栄養分から抽出する酸化酵素(オキシダーゼ)です。この酵素は、呼吸で取り入れた気体の酸素分子(O2)によって糖質や脂質を酸化することにより、エネルギーを獲得します。呼吸酵素には、ヒトや家畜など動物のミトコンドリアにもある「ヘム銅型酸化酵素」と、微生物に特有な「シトクロムbd型酸化酵素」があります。このうち、ヘム銅型酸化酵素の研究は古くから進んでいて、歴史的に日本の研究者も大きく貢献してきました。3年前に本学の坂本教授のグループは、ドイツのマックス-プランク生物物理学研究所のミヘル教授らのグループと共同で、世界で初めてbd型酸化酵素の精密な立体構造を解明しました。その際 研究対象にしたのは、温泉や熱い地中などの自然界に生息する「好熱菌」という細菌でした。
今回は、ヒトの体内に住む「大腸菌」のbd型酸化酵素を対象にして、2つ目の精密立体構造を明らかにしました。同じbd型に分類されるとはいえ、事前の予想をはるかに超える違いがあったので、やはり画期的な発見として、世界的に評価の高い学術誌Scienceに再び掲載されました。その主な違いには、具体的には次のような点が含まれます;
① 酵素反応に重要な補欠分子族であるヘムbとヘムdの配置が逆転していた。
② それらヘムの化学的性質(酸化還元電位)も逆転した上、さらに大きくずれていた。
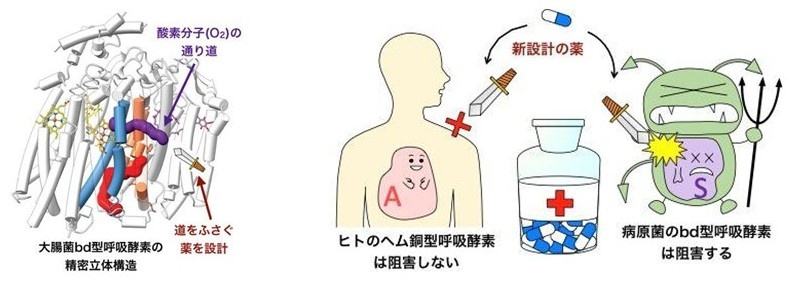
③ 酵素分子内にある酸素分子(O2)の通り道が、好熱菌の場合と全然違う場所にあった(下図左)。
④ 新しいサブユニット(短いペプチド)が見つかり、それがO2の通り道を決定づけていた。
坂本教授らがすでに明らかにしていた酵素反応速度の違いなどとも合わせて考えると、bd型酸化酵素は、構造だけでなく機能にも多様性があると考えられます。大腸菌の酵素はエネルギー獲得を主な機能としているのに対し、好熱菌の酵素はむしろ「酸素毒性」の解毒作用を主に果たすと考えられます。
前回の好熱菌は、「グラム陽性菌」に分類されますが、今回の大腸菌は「グラム陰性菌」に入ります。学術的に重要な2大群の微生物で呼吸酵素の立体構造がそろい、多様性の幅が具体的に明らかになったといえます。また前回と今回では、精密分子構造を解析した手法も違っています。前回はX線結晶構造解析という伝統的な方法でしたが、今回は最近進歩の著しい単粒子低温電子顕微鏡法(クライオ電顕)という新しい方法を使いました。前回は、本学の坂本教授とドイツのミヘル教授の2グループだけで行いましたが、今回はさらに大きな国際共同研究組織となり、ドイツの2研究室を中心にフランス・米国からも加わり、日本からも本学に加え京都大学の研究者が参加しました。
このbd型酸化酵素は、結核菌やジフテリア菌・サルモネラ菌・大腸菌などの病原菌を含む多くの微生物の生存や増殖に必要なタンパク質分子であり、その最初の発見も我が国(と米国)でなされました。今回と前回明らかになった3次元構造の座標データを元に、生命情報学(バイオインフォマティクス)の手法を用いれば、創薬・医療分野での応用が期待されます。結核は今でも、世界で毎年百万人規模の犠牲者を出す世界3大感染症の1つです。また病原性大腸菌O-157などによる「新興感染症」もたびたび出現しています。メチシリン-セフェム耐性黄色ブドウ球菌(MRSA)など、従来の薬が軒並み効かない多剤耐性菌は先進国でも問題になっており、まったく新しいタイプの抗菌薬の開発が期待されます。微生物特有のbd型酸化酵素にはピッタリ当てはまるが、ヒトや家畜のヘム銅型酸化酵素には悪影響のない分子を設計することにより、病原菌の「息の根を止める」新しい治療薬の選択肢を増やしうるでしょう(下図右)。
なお、本研究は、日本学術振興会 科学研究費補助金 基盤研究 等の支援を受けて実施しました。